Una reacción
química, cambio químico o fenómeno químico, es todo proceso
termodinámico en el cual una o más sustancias (llamadas reactantes o
"reactivos"), se transforman, cambiando su estructura
molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes
pueden ser elementos o compuestos. Un ejemplo de reacción
química es la formación de óxido de hierro producida al reaccionar el oxígeno del
aire con el hierro de forma natural, o una cinta
de magnesio al colocarla en una llama se convierte en óxido de
magnesio, como un ejemplo de reacción inducida.
LOS CAMBIOS EN LA MATERIA
La materia puede sufrir
cambios mediante diversos procesos. No obstante, todos esos cambios se pueden
agrupar en dos tipos: cambios físicos y cambios químicos.
CAMBIOS FÍSICOS
En estos cambios no se
producen modificaciones en la naturaleza de la sustancia o sustancias que
intervienen. Ejemplos de este tipo de cambios son:
Cambios de estado.
Mezclas.
Disoluciones.
Separación de sustancias en
mezclas o disoluciones.

CAMBIOS QUÍMICOS
En este caso, los cambios si
alteran la naturaleza de las sustancias: desaparecen unas y aparecen otras con
propiedades muy distintas. No es posible volver atrás por un procedimiento
físico (como calentamiento o enfriamiento, filtrado, evaporación, etc.)
Una reacción química es
un proceso por el cual una o más sustancias, llamadas reactivas, se
transforman en otra u otras sustancias con propiedades diferentes, llamadas productos.
En una reacción química, los
enlaces entre los átomos que forman los reactivos se rompen. Entonces, los
átomos se reorganizan de otro modo, formando nuevos enlaces y dando lugar a una
o más sustancias diferentes a las iniciales.
ECUACIONES QUÍMICAS
Una reacción química se
representa mediante una ecuación química. Para leer o escribir una
ecuación química, se deben seguir las siguientes reglas:
Las fórmulas de los
reactivos se escriben a la izquierda, y las de los productos a la derecha,
separadas ambas por una flecha que indica el sentido de la reacción.
A cada lado de la reacción,
es decir, a derecha y a izquierda de la flecha, debe existir el mismo número de
átomos de cada elemento.
Cuando una ecuación química
cumple esta segunda regla, se dice que está ajustada o equilibrada.
Para equilibrar reacciones químicas, se ponen delante de las fórmulas unos
números llamados coeficientes, que indican el número relativo de átomos y
moléculas que intervienen en la reacción.
Nota: estos coeficientes
situados delante de las fórmulas, son los únicos números en la
ecuación que se pueden cambiar, mientras que los números que aparecen dentro
de las fórmulas son intocables, pues un cambio en ellos significa un
cambio de sustancia que reacciona y, por tanto, se trataría de una reacción
distinta.
Si se quiere o necesita
indicar el estado en que se encuentran las sustancias que intervienen o si se
encuentran en disolución, se puede hacer añadiendo los siguientes símbolos
detrás de la fórmula química correspondiente:
(s) = sólido.
(metal) = elemento metálico.
(l) = líquido.
(g) = gas.
(aq) = disolución acuosa (en
agua).
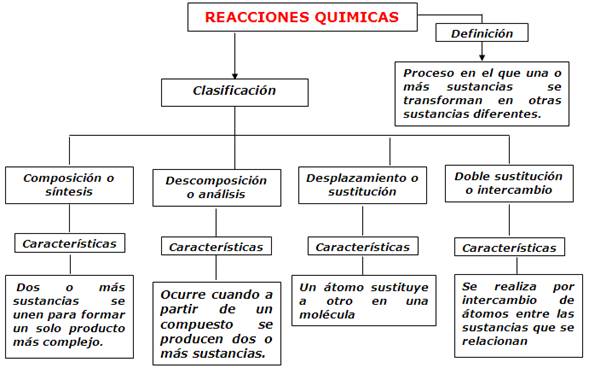
CLASIFICACIÓN REACCIONES
CLASIFICACIÓN REACCIONES
REACCION DE COMPOSICIÓN O SÍNTESIS: En
las reacciones de síntesis o composición es donde dos reactantes se combinan
para formar un solo producto. Muchos elementos reaccionan con otro de esta
manera para formar compuestos, por ejemplo:
2CaO(s) + 2H2O(l) →
2Ca(OH)2(ac)
En esta fórmula se mezclan 2 moles de oxido de calcio sólido con 2 moles
de agua líquida reacciona produciendo 2 moles de dihidroxido
de calcio acuoso.
REACCION DE DESCOMPOSICION O ANÁLISIS: Este
tipo de reacción es contraria a la de composición o síntesis ya que en esta no
se unen 2 o más moléculas para formar una sola, sino que una sola molécula se
divide o se rompe para formar varias moléculas mas sencillas, por ejemplo:
2HgO (s) → 2Hg(l) + O2(g)
En esta formula una 2 molécula de oxido de mercurio sólido se descomponen o dividen para formar 2
moléculas de mercurio y una de oxigeno, las cuales son mas sencillas que la primera.
REACCION DE DESPAZAMIENTO O SUTITUCION: En este tipo de reacción, un elemento
libre sustituye y libera a otro elemento presente en un compuesto, su ecuación
general es:
CuSO4 + Fe → FeSO4 + Cu
En esta reacción un mol de sulfato de cobre con 1 mol de hierro para formar sulfato de hierro y
cobre
REACCION DE DOBLE SUTITUCION O DOBLE
DESPLAZAMIENTO: Son
aquellas reacciones que se dan por intercambio de átomos entre los reactivos AB
+ CD----------------- AC + BD Por Ejemplo:
K2S + MgSO4 → K2SO4 + MgS
En esta reacción 1 mol de sulfuro de potasio reaccionan con sulfato de
magnesio para formar sulfato de potasio y sulfuro de magnesio. Es difícil
encontrar reacciones inorgánicas comunes que puedan clasificarse correctamente
como de doble sustitución
IMPORTANCIA DE LAS REACCIONES QUÍMICAS
Estamos rodeados por
reacciones químicas; tienen lugar en laboratorios, pero también en fábricas,
automóviles, centrales térmicas, cocinas, atmósfera, interior de la Tierra...
Incluso en nuestro cuerpo ocurren miles de reacciones químicas en cada instante,
que determinan lo que hacemos y pensamos.
De toda la variedad de
reacciones posibles, vamos a ver dos: las de neutralización y las de combustión.
Pero antes de verlas, es necesario conocer y dominar el concepto de ácido y
base.




No hay comentarios:
Publicar un comentario