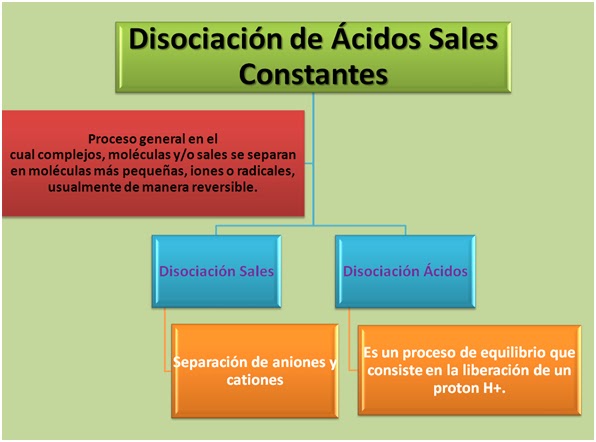
Disociación en química es
un proceso general en el cual complejos, moléculas y/o sales se
separan en moléculas más pequeñas, iones o radicales, usualmente
de manera reversible. Disociación es lo opuesto de la asociación, síntesis
química o a la recombinación.
Cuando un ácido de
Brønsted-Lowry se pone en el agua, un enlace covalente entre un átomo
electronegativo y un átomo de hidrógeno se rompe por la fisión heterolítica, lo
que da un protón y un ion negativo.
Constante de disociación
La Constante de disociación o Kd es
definida en termodinámica química como la relación matemática
que se establece a partir de las concentraciones de los compuestos químicos que
se forman en una reacción de disociación al alcanzar su punto
de equilibrio.
Sales
La disociación en sales por solvatación en
un solvente como agua significa la separación de
los aniones y cationes. La sal puede recuperarse por
la evaporación del solvente o por cristalización al reducir
la temperatura.
Ácidos
La disociación de los ácidos en
una solución significa la liberación de un protón H+, éste es un
proceso de equilibrio, esto quiere decir que disociación y la recombinación
ocurren al mismo tiempo con la misma velocidad. La constante de
disociación de los ácidos Ka indica qué tan fuerte es un ácido, los
ácidos fuertes poseen una Ka de mayor valor (por lo tanto menor pKa). El
estudio de estos equilibrios se llama Equilibrio ácido-base.
IONIZACIÓN DEL AGUA
Ionización del agua. La
ionización surge a partir de fenómenos naturales y su efecto es bien conocido
desde la antigüedad. La ionización es el proceso
químico o físico mediante el cual se producen iones, estos son átomos o
moléculas cargadas eléctricamente debido al exceso o falta de electrones
respecto a un átomo o molécula neutra. A la especie química con más electrones
que el átomo o molécula neutra se le llama anión, y posee una carga neta
negativa, y a la que tiene menos electrones catión, teniendo una carga neta
positiva.
Equilibrio
iónico del agua
El agua pura es un
electrolito débil que se disocia en muy baja proporción en sus iones hidronio o
hidrógeno H3O+ (también escrito como H+) e hidróxido o
hidróxilo OH–. Dos moléculas polares de agua pueden ionizarse debido a las
fuerzas de atracción por puentes de hidrógeno que se establecen entre ellas.
Al producto de la
concentración de iones hidroxonio o hidronio (H3O+) por la concentración de iones hidróxido o
hidroxilo (OH−) se le denomina producto iónico del agua y se representa como
Kw. Las concentraciones de los iones H+ y OH– se expresan en moles / litro
(molaridad). Este producto tiene un valor constante igual a 10−14 a 25º C.
Debido a que en el agua pura
por cada ion hidronio (o ion hidrógeno) hay un ion hidróxido (o hidroxilo), la
concentración es la misma.
Las concentraciones de
hidronios (también llamada de protones) (H+) y de hidroxilos (OH-) son
inversamente proporcionales; es decir, para que el valor de la constante de
disociación se mantenga como tal, el aumento de una de las concentraciones
implica la disminución de la otra.
IONIZACIÓN
DEL PH
Ionización
del agua y el pH
El agua no es un líquido
químicamente puro, ya que se trata de una solución iónica que siempre contiene
algunos iones H3O+ y OH–. El producto [H+]•[OH-]= 10–14 se denomina producto
iónico del agua. Ese valor constituye la base para establecer la escala de pH,
que mide la acidez o alcalinidad de una disolución acuosa; es decir, su
concentración de iones [H+] o [OH–], respectivamente.
Concepto
de pH
El pH es una medida de la
acidez o alcalinidad de una solución. Lo que el pH indica exactamente es la
concentración de iones hidronio (o iones hidrógeno) — [H3O+] o solo [H+]—
presentes en determinadas sustancias.
La sigla pH significa
"potencial de hidrógeno" (pondus Hydrogenii o potentia Hydrogenii; del
latín pondus, = peso; potentia, = potencia; hydrogenium, =hidrógeno).
Este término fue acuñado por el químico danés Sorensen, quien lo definió como
el logaritmo negativo
de base 10 de la actividad de los iones hidrógeno.
AMORTIGUADORES
Para que uno se mantenga saludable, hay muchos fluidos en nuestro cuerpo que se tienen que mantener dentro de unos límites muy estrechos de pH, para que esto se realice se crea un sistema amortiguador.
Un sistema amortiguador es
una solución que puede absorber grandes cantidades moderadas de ácidos y bases
sin un cambio significativo de pH, es decir, una disolución que contiene unas
substancias que inhiben los cambios de pH, o concentración de ión hidronio en
la solución. Dichas sustancias pueden contener un ácido débil y su sal, por
ejemplo:
·
ácido acético
·
acetato de sodio
O una base débil y una sal
de esa base, por ejemplo:
·
hidróxido de amonio
·
cloruro de amonio
Los amortiguadores tienen
máxima eficiencia para neutralizar los ácidos y las bases que se añaden, cuando
las concentraciones del ácido débil (o base débil) y de la sal son iguales.
La solución amortiguadora
entonces es una solución conformada por un ácido débil y una base débil y su
sal que tiene la capacidad de resistir los cambios de pH cuando se agregan
pequeñas cantidades de ácidos o de bases.






No hay comentarios:
Publicar un comentario